中科院西安光机所姚保利研究员团队在《激光与光电子学进展》发表题为“光片荧光显微及应用进展”的特邀综述文章,系统介绍了光片荧光显微成像技术的基本原理,主要技术问题及解决方案,列举了其在生物医学中的应用,讨论了该技术的发展趋势及前景。
 封面文章|于湘华,刘超,柏晨,杨延龙,彭彤,但旦,闵俊伟,姚保利. 光片荧光显微成像技术及应用进展[J]. 激光与光电子学进展, 2020, 57(10): 100001
封面文章|于湘华,刘超,柏晨,杨延龙,彭彤,但旦,闵俊伟,姚保利. 光片荧光显微成像技术及应用进展[J]. 激光与光电子学进展, 2020, 57(10): 100001
撰稿人|于湘华
背景介绍
相比经典的宽场荧光显微成像和激光扫描共聚焦显微成像,光片荧光显微能够克服光毒性、光漂白性等缺点,是活体样品长时间三维成像的理想工具。
光片荧光显微原理如动画1所示。采用正交光路设计,用一层薄光片从侧面激发样品,并在垂直于光片的方向上利用显微物镜和数字相机拍摄样品的二维荧光图像,通过轴向扫描光片或移动样品逐面成像,即可获取不同深度处的层析图像并实现样品的三维信息重构。
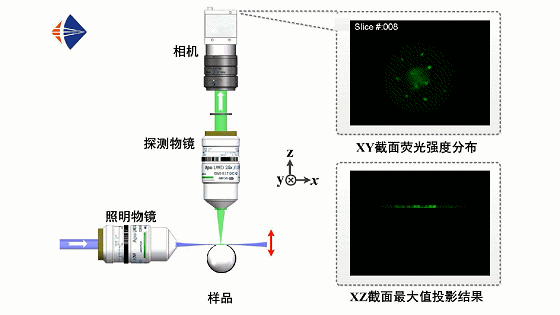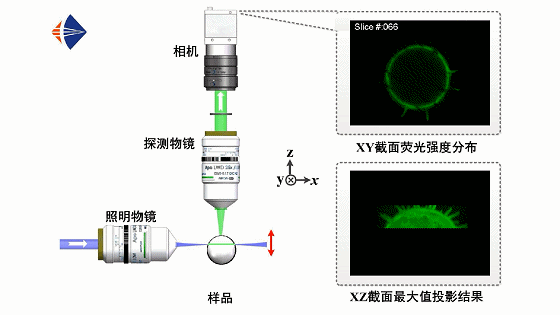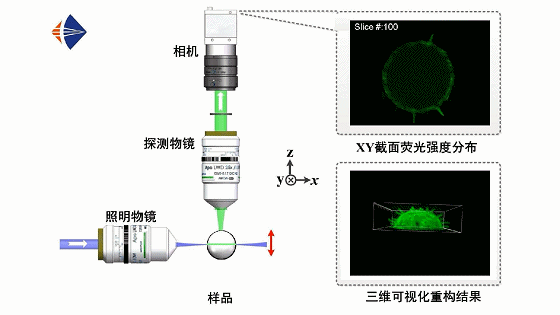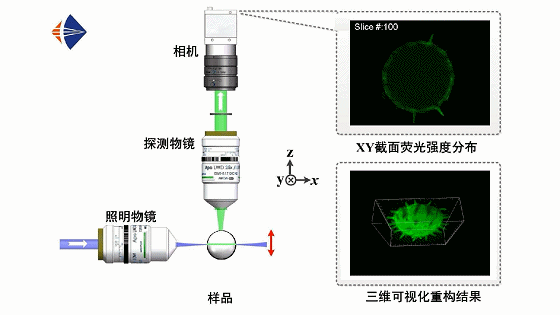
动画1 光片荧光显微工作原理动画
论文详解
01 光片荧光显微简介
第一部分,作者对光片显微基础理论做了介绍,主要从光片荧光显微的特点和光片生成的方法两方面进行了解释。
1.1 光片荧光显微的特点
文中将光片荧光显微成像与传统落射式荧光显微成像、激光扫描共聚焦显微成像做对比。
与传统落射式荧光显微构架不同(如图1b所示),光片荧光显微正交独立的激发和探测光路(如图1a所示),从侧面用一层薄的光片照明样品,仅激发成像物镜焦面薄层区域的样品,在正交方向上进行探测成像,这样能有效避免离焦背景对成像质量的影响,具有成像对比度高和天然光学层析的优点。
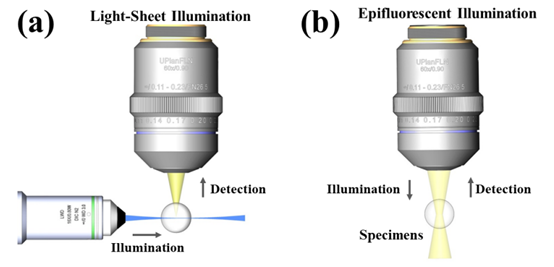
图1 两种显微成像方式对比。(a) 光片荧光显微从侧面用薄光片照明,只激发探测物镜焦平面处的样品发射荧光,在正交方向上收集荧光信号成像;(b) 落射式荧光显微用同一物镜激发和收集荧光,光束经过的在焦和离焦样品都会被激发,会增大光损伤。
与激光扫描共聚焦显微成像相比,光片荧光显微所需激光能量仅为其的1/1000,且避免了多次重复不必要的照明激发,降低了光漂白和光毒性,因而适宜于长时间对对活体生物样品进行成像。
与逐点扫描成像模式相比,光片荧光显微采用逐面成像方式,因此具有成像速度快的优势。
1.2 光片生成的方法
光片的生成是光片荧光显微成像技术的核心。文中从柱面镜聚焦(如图2(a)所示)和光束扫描生成 (如图2(b)所示)两部分进行介绍。柱面镜聚焦,2004年首次提出使用,但其能量利用率低、限制其他类型光片场生成等缺陷,2008年,光束扫描生成法提出且使用。光束扫描生成法,用扫描振镜快速扫描激光束,经过显微物镜聚焦后可生成一个动态的光片,具有强度分布更均匀,激光能量利用率更高和生成光片种类更丰富的优点,应用在很多光片荧光显微成像系统中。
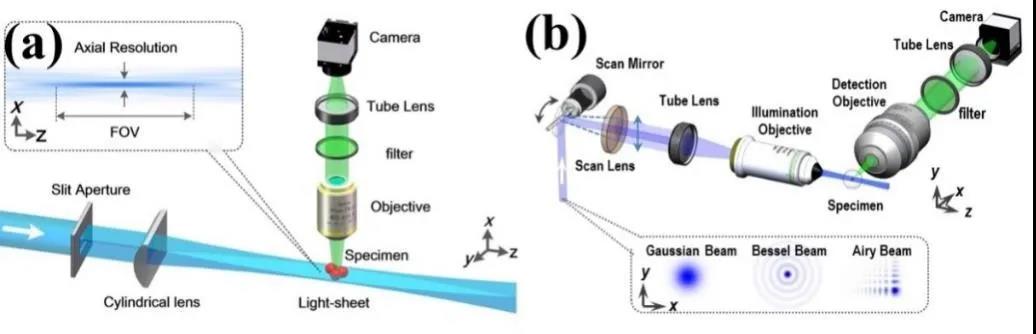
图2 两种光片生成方法的光片荧光显微原理图。(a) 使用柱面镜聚焦方法生成光片;(b) 利用振镜快速扫描光束生成光片。
02 光片荧光显微的主要技术问题
第二部分,作者详细介绍了光片荧光显微的主要技术问题,从四个方面进行了分析:空间分辨率与视场相互制约问题、光学衍射极限限制超分辨成像问题、成像速度问题、成像质量和成像深度问题。
2.1 空间分辨率和视场相互制约
影响光片显微成像性能的因素:系统的轴向分辨率由探测物镜的数值孔径与激发光片的厚度共同决定,视场受限于光片宽度。
目前的解决方案存在一定弊端:传统高斯光片场的厚度和宽度会随着柱面镜焦距的增大或照明物镜的数值孔径的减小而增大,大的视场通常以牺牲轴向分辨率和三维层析成像能力为代价。通过扫描具有无衍射特性的贝塞尔光束、艾里光束等生成新型光片场,可以扩大光片荧光显微系统观测视场 (动画2所示)。然而贝塞尔光束的同心环状旁瓣产生的离焦背景噪声,既降低成像对比度和系统轴向分辨率,又增大了光漂白和光毒性效应。

动画2 高斯光片和贝塞尔光片对比
为了解决上述问题,作者团队提出了互补光束相减光片荧光显微成像技术,原理如图3所示,分别用贝塞尔光片和互补光片照明样品拍摄两幅荧光图像,然后将两幅图像相减,可消除贝塞尔光束旁瓣对成像结果的影响,从而实现大视场高轴向分辨率成像[1, 2]。 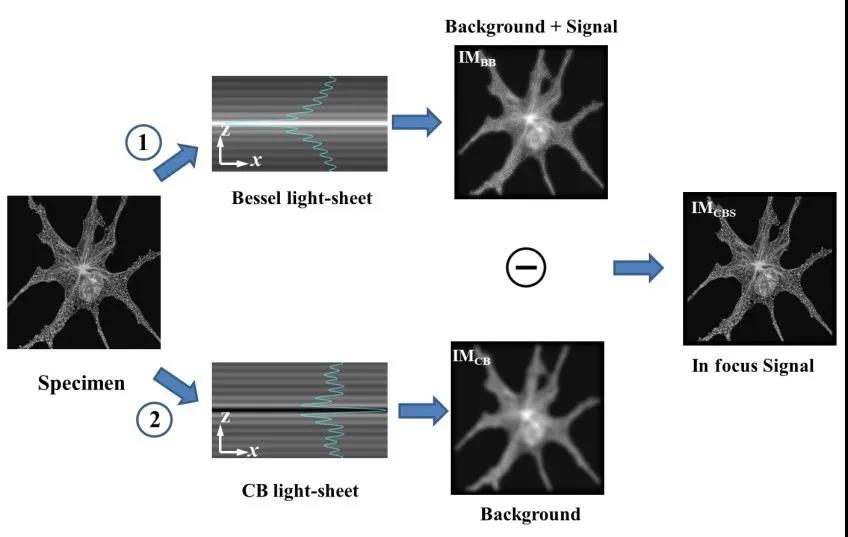 图3 无衍射互补光束相减光片荧光显微的原理图
图3 无衍射互补光束相减光片荧光显微的原理图
2.2 突破光学衍射极限实现超分辨成像
由于普通光片荧光显微系统的横向分辨率受到瑞利-阿贝衍射极限的限制,由探测物镜的数值孔径和荧光波长决定,在可见光范围内横向分辨率只能达到约200nm。能否突破光学衍射极限进一步提高空间分辨率实现超分辨成像是一个重要的问题。文中提到,光片荧光显微与超分辨技术的有机结合可突破光学衍射极限实现超分辨三维成像。2014年, E. Betzig等人提出了一种全新的技术:晶格光片荧光显微,实现了150 nm空间分辨率的超分辨成像。后来,F.Zanacchi等人将单分子定位超分辨技术引入到光片荧光显微成像中,将空间分辨率提高到60nm。
2.3 提高成像速度
成像速度(二维成像速度和三维成像速度)是衡量光片荧光显微性能的另一个非常重要的指标。其中二维成像速度主要由相机决定,三维成像速度则受光片和样品相对移动速度、相机速度、硬件同步及数据传输等因素影响。
2.4 提高成像质量和成像深度
对于成像质量,由于显微系统或样品本身引起的像差会降低图像对比度和信噪比,影响成像质量,因此有必要对像差进行校正,如增加变形镜等。对于成像深度,由于生物体内不同物质折射率的差异,生物组织通常不太透明,对组织深部进行高时空分辨率无创三维光学成像具有很大的挑战性。生物组织对近红外光的吸收和散射比可见光弱,因此用近红外超短脉冲激光作为光源的双光子光片荧光显微可提高成像深度。除了上述提到的利用提升光片荧光显微成像系统软硬件外来提高成像质量和成像深度外,利用生物化学技术对样品进行前期处理,如组织透明化技术,也是一种行之有效的策略。组织透明化技术的发展让原本不透明的组织、器官甚至完整生物体的光学特性提升,避免传统组织切片技术对样品完整性的机械破坏,结合光片荧光显微实现亚细胞尺度的三维清晰成像,具有革命性意义。
03 光片荧光显微的主要应用
第三部分,文中介绍了光片荧光显微的应用,从细胞生物学、发育生物学、神经科学三方面进行阐述。
在细胞生物学领域,光片荧光显微可用于研究细胞内分子扩散规律与机制、大分子间相互作用、细胞与细胞之间的相互作用等各种生理规律,是细胞生物学研究领域中非常重要的显微成像工具,如图4所示。 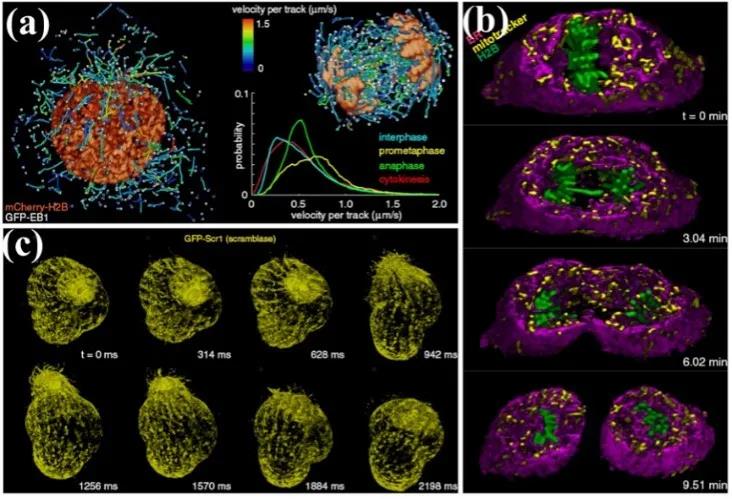
图4 光片荧光显微用于观察细胞有丝分裂[3]
在发育生物学领域,光片荧光显微具有光损伤低和快速三维层析成像的优势,适宜于对发育中的生物体进行长时间显微成像。它已经成功用于对斑马鱼、果蝇、秀丽隐杆线虫等模式动物的胚胎发育过程的长时间三维显微成像,如图5所示。 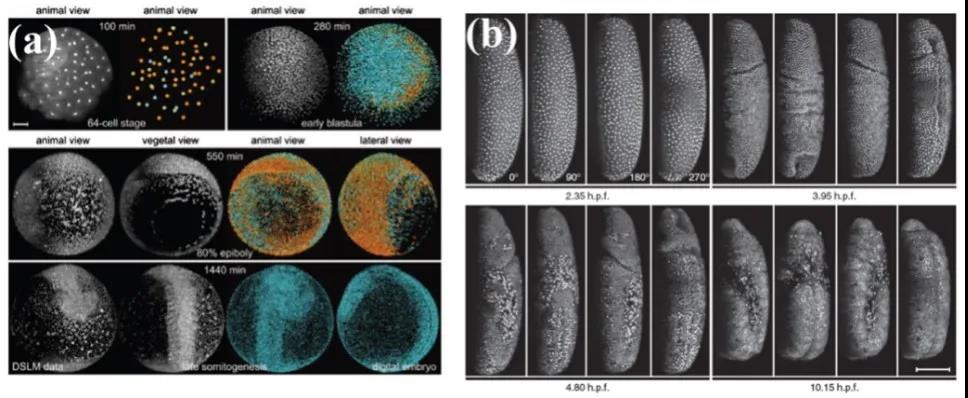 图5 光片荧光显微用于观察斑马鱼和果蝇胚胎发育[4]
图5 光片荧光显微用于观察斑马鱼和果蝇胚胎发育[4]
在神经科学领域,对整个大脑进行细胞或亚细胞尺度分辨率的三维无创显微成像,获取全部神经元的位置、形态和行为信息,有利于研究神经回路进而理解脑内过程和神经机制。光片荧光显微是实现小型脊椎动物和无脊椎动物全脑成像的出色工具,如图6所示。
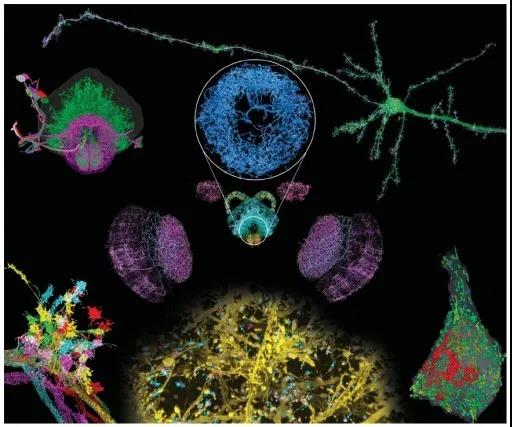
图6 光片荧光显微用于神经科学研究[5]
总结与展望
光片荧光显微成像技术具有高空间分辨率、低损伤、快速和三维层析成像的特点,已成功应用于细胞生物学、发育生物学和神经科学等领域,是对活体生物样品进行长时间三维成像的理想工具。实现更深的成像深度、更高的空间分辨率和更快的成像速度仍然是光片荧光显微技术面临的挑战。自适应光学技术以及近红外荧光标记可以帮助提高成像深度,并行化光片荧光架构可以进一步提高成像速度,结合实时的计算图像分析方法和光学微操纵技术可以使其成为数据驱动的微观世界互动平台,为人们探索生命的奥秘提供更有利的工具。
参考文献
[1] Hao Jia, Xianghua Yu, Yanlong Yang, Xing Zhou, Shaohui Yan, Chao Liu, Ming Lei, and Baoli Yao. Axial resolution enhancement of light-sheet microscopy by double scanning of Bessel beam and its complementary beam[J]. Journal of Biophotonics, 2019: 201800094-1-10.
[2] Chen Bai, Chao Liu, Hao Jia, Tong Peng, Junwei Min, Ming Lei, Xianghua Yu, Baoli Yao. Compressed Blind Deconvolution and Denoising for Complementary Beam Subtration Light-Sheet Fluorescence Microscopy[J]. IEEE Transactions on Biomedical Engineering, 2019, 66(10): 2979-2989.
[3] Bi-Chang Chen, Wesley R Legant, Kai Wang, et al. Lattice light-sheet microscopy Imaging molecules to embryos at high spatial temporal resolution[J].Science, 2014, 346: 1257998.
[4] Philipp J. Keller, Annette D Schmidt, Joachim Wittbrodt, et al. Light-sheet fluorescence microscopy for quantitative biology[J]. Science, 2008, 322: 1065.
[5] Ruixuan Gao, Shoh M. Asano, Sigokul Upadhyayula, et al. Cortical column and whole brain imaing with molecular contrast and nanoscale resolution[J].Science, 2019, 363: 8302.




 陕公网安备 61019002001027号
陕公网安备 61019002001027号